
最近学习了一篇关于微生物免疫治疗方面的文章,记录一下,基本上是从ppt中摘录的。
背景
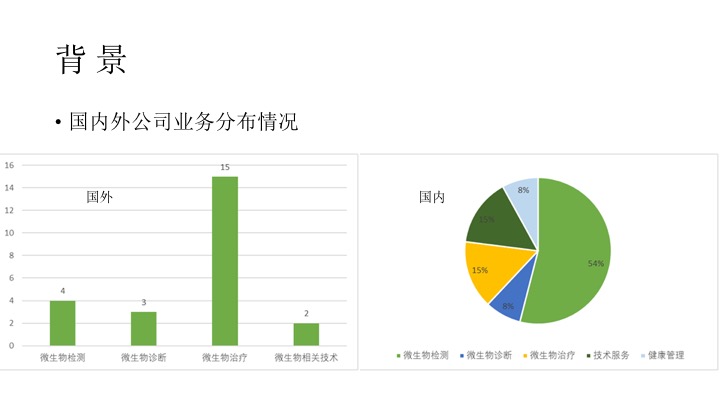
先来看一下背景,在业务领域方面的分布方面,国内外呈现非常不同的分布。15家的国外初创企业布局微生物治疗,布局微生物检测的公司只有4家,微生物相关技术(如数据库及数据分析,口服制药技术)有2家,微生物诊断公司有3家。
中国微生物公司主要布局检测,共7家(54%),主要提供科研服务或者肠道菌群检测服务和产品;微生物治疗领域有2家公司(15%),主要治疗溃疡性结肠炎及抗菌药相关性腹泻和艰难梭菌相关性腹泻;诊断方面有1家公司,技术服务型公司有2家,专注于提供菌群的分离和培养,提供产业化、产品化解决方案及肠道微生态的AI制药平台,健康管理方面有1家。
目前,有多家生物医药公司在发掘人类肠道微生物菌群中的信息,力图设计出基于肠道微生物菌群中特定“好”细菌的创新疗法。它们可以用来治疗例如艰难梭菌(Clostridium difficile)感染等可能致命的严重感染,也可以用来调控肠道的免疫反应,治疗诸如克罗恩病,溃疡性结肠炎等IBD。由于肠道微生物的免疫调节功能,研究发现它可以明显影响癌症患者对癌症免疫疗法的反应。而肠道与大脑的联系也吸引了科学家们探索通过影响肠道微生物来治疗精神性疾病的方法。
摘要

人体的肠道中寄生着大量的微生物,这一微生物生态系统与人体产生紧密的相互作用,影响到人体生理学的多个方面。因此肠道菌群失调可能与多种疾病相关,其中包括炎症性肠病(IBD),癌症,自闭症,以及包括糖尿病,心血管疾病和肥胖症在内的代谢类疾病。
《Nature Reviews Immunology》上发表的一篇综述文章,系统性介绍了菌群对免疫系统的调节作用,并阐释了设计基于菌群的免疫疗法的两种策略。
现状

甚至是门的差别,尽管厚壁和拟杆菌占了大多数。
我们需要开发理性设计的微生物疗法,找出详细验证过的细菌种类,用已经阐明的机制来治疗特定疾病。那么,如何才能够找到这些“好”细菌种类,并且发现治疗特定疾病的机制?

发掘微生物与宿主健康之间因果关系
效应
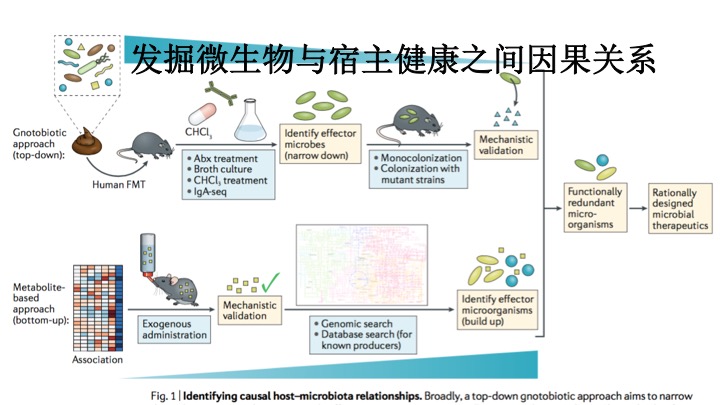
目前发掘特定微生物种类与宿主健康之间因果关系的手段可以大致被分为两类,这两类研究方法可以起到相辅相成的作用。
第一类研究方法使用称为悉生动物(gnotobiotic animals)的动物模型来研究一种或少数几种细菌对宿主的影响。这些动物模型使用肠道中没有细菌的无菌动物,然后在它们肠道中引入一种或几种细菌,并且分析这些细菌带来的影响。将这些细菌植入到疾病模型(例如肥胖症)中可以进一步分析它们对治疗或者加重特定疾病的影响和作用机制。
另一种方法是分析在疾病状态下发生变化的微生物分子或代谢物。使用这种策略,研究人员可以通过分析宏基因组数据(metagenomics data)来发现与特定疾病相关的生物合成信号通路,并且据此发现多种拥有这一生物合成信号通路的微生物。
真菌、原生动物、病毒和是蠕虫没有考虑。
无菌动物研究可缩小所有微生物到某一具体的效应株。
第一,从一个复杂微生物体(源自人粪便或鼠源菌群),已明确其具有促进机体表型的功能,可采用下面任一方法来缩小范围:抗生素处理、体外培养、氯仿处理(富集芽孢菌)、细胞分类及Ig A包被的细菌16S rRNA测序(Ig A-seq)。筛选出的部分菌用于免疫调节试验,进一步缩小范围直到鉴定出最小范围的菌群。后将所获得的菌纯培养或进行基因工程研究以明确机制。
第二,自下而上的互补研究途径从小分子代谢物质开始,与机体表型有关。首先通过外服该物质建立代谢物与表型的因果关系,通过查找文献和数据库,开展菌加工和生物合成生产此物质。许多种菌的代谢途径是保守的,可能会鉴别出几种具有同种功能的几个效应菌株。联合无菌研究和代谢物途径研究可明确某种菌株影响免疫表型的因果关系,这些菌株可联合用于构建菌群治疗。


微生物介导的免疫调节
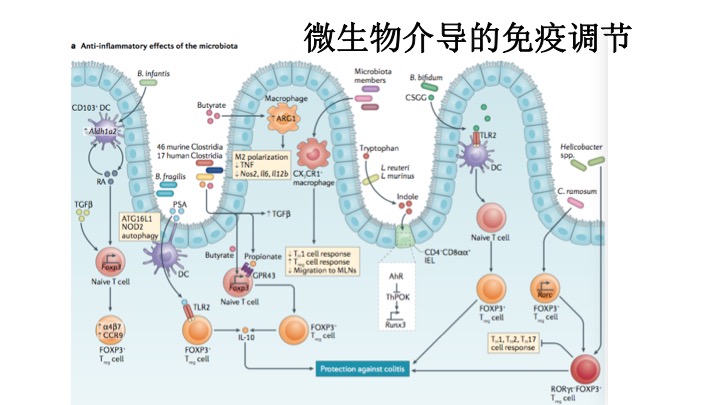
肠道菌的抗炎免疫调节。从左到右:
B. infantis-维生素A或维生素A酸(RA)-促进树状突细胞Aldh1a2 (视网膜脱氢酶2)表达。产生高浓度的维生素A酸,与转化生长因子β (TGFβ)结合,促进初始T细胞分化成叉头蛋白质 P3(FOXP3)+调节T (Treg)细胞,上调gut-homingα4β7整合素和CC-趋化因子受体9 (CCR9) 表达。
源于B. fragilis 细胞壁的多糖A(PSA)通过类1型自噬相关蛋白16和核结合寡聚结构域蛋白质2依赖的自噬途径转运到肠固有层外膜囊泡。多糖A信号通路是通过 FOXP3+Treg 细胞上的TLR2受体介导细胞增殖,产生IL-10,提高抗炎反应。
46种鼠源或17种人源梭菌产生的短链脂肪酸(SCFAs)可产生这些相似的抗炎反应。
丁酸盐抑制组蛋白脱乙酰酶,丙酸盐信号通过GPR43,从而增加Foxp3启动子和相关的增强子位点的转录等。丁酸盐通过上调精氨酸酶1(ARG1)表达促进M2样巨噬细胞极化,并因此促进抗炎活性,最终降低肿瘤坏死因子(TNF)的产生,并降低Nos2,Il6和Il12b的表达。
菌群成员诱导CX3CR1 +巨噬细胞,限制T辅助细胞1(TH1)细胞反应,促进Treg细胞反应并减少巨噬细胞向肠系膜淋巴结(MLNs)的迁移。
色氨酸通过包括罗伊氏乳杆菌和鼠乳杆菌等分解代谢为吲哚。吲哚衍生物通过CD4 +上皮内淋巴细胞(IEL)中的芳烃受体(AhR)发出信号,以下调T辅助诱导POZ / Kruppel样因子(ThPOK)的表达,从而诱导RUNX3表达,从而促进分化成CD4 +CD8αα+ IEL。两歧双歧杆菌产生细胞表面β-葡聚糖/半乳聚糖(CSGG)多糖,其通过DC上的TLR2发信号,以诱导FOXP3 + Treg细胞。该细胞由几种肠道共生菌诱导,最有效的是梭菌(C. ramosum),也可以通过稳态条件下的幽门螺杆菌等病原体诱导。
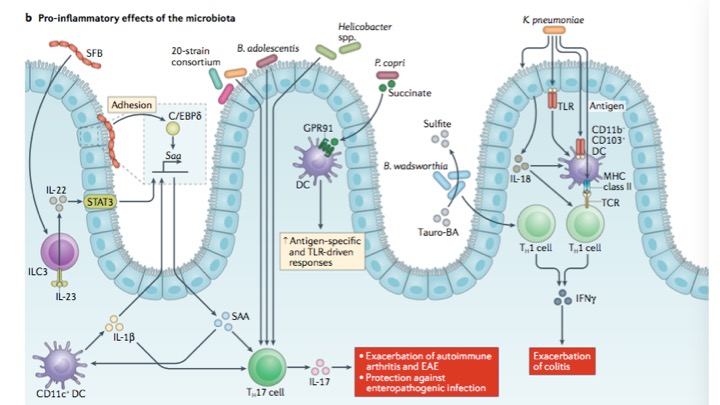
肠道菌的促炎免疫调节。从左到右:
粘附在肠道上皮的分节丝状菌(SFB),刺激转录因子C/EBPδ,上调血清淀粉样蛋白A (SAA) 表达,SAA诱导辅助T细胞17(TH17)产生IL-17,SAACD11c+ DCs产生IL-1β,IL-1β使SAA放大回路形成。IL-23 使ILC3s分泌iL-22,通过信号转导,上皮细胞中转录激活因子3(STAT3)进一步刺激SAA的表达。没有粘附在上皮细胞的分节丝状菌也通过IL-23信号通路诱导ILC3s表达IL-22。
从溃疡性结肠炎病人上分离到双歧杆菌B. adolescentis和同属的20株菌,可通过上皮粘附诱导TH17细胞。Helicobacter 等致病菌在炎症期间诱导抗原特异性TH17细胞。TH17和相关的细胞因子又称IL-17,促进肠道促炎性反应。共生菌Prevotella copri 产生琥珀酸盐,通过树状突细胞GPR91 信号通路增强抗原特异性及TLR介导的免疫反应。B. wadsworthia减少牛磺酸解偶联成亚硫酸盐,有利于菌自身的代谢和繁殖,诱导TH1细胞产生IFNγ,K. pneumoniae 有类似的效应。
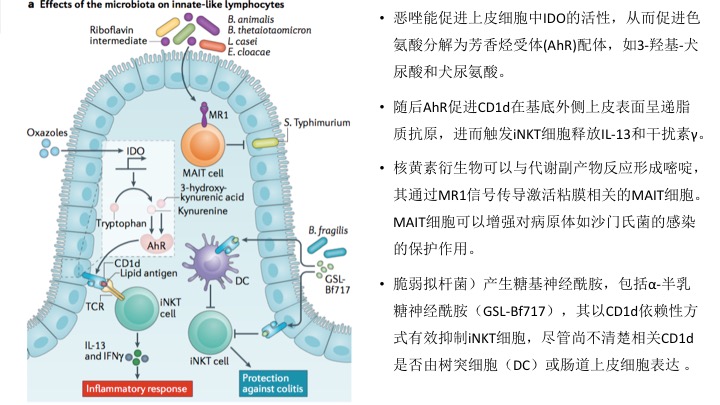
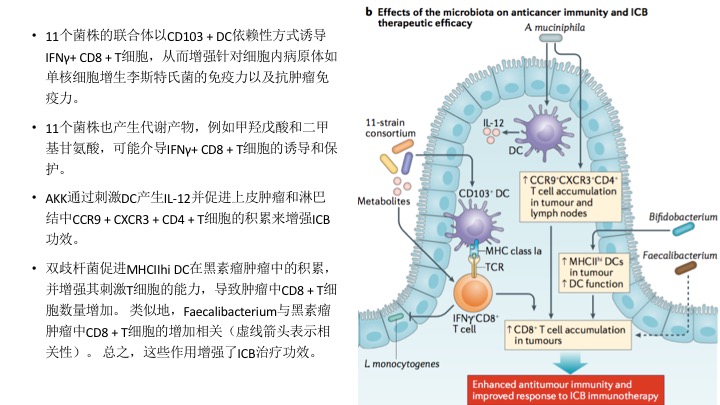


微生物疗法


使用悉生动物和基于代谢物的研发手段已经发现了很多具有免疫调节作用的细菌和细菌代谢物。它们对宿主免疫细胞的影响和影响免疫反应的机制对理性构建微生物疗法至关重要。

